Pengarang:
Bobbie Johnson
Tanggal Pembuatan:
10 April 2021
Tanggal Pembaruan:
1 Juli 2024

Isi
- Langkah
- Bagian 1 dari 2: Siapkan Peralatan
- Bagian 2 dari 2: Lakukan eksperimen
- Tips
- Peringatan
- Apa yang kamu butuhkan
Proses pemisahan air (H2O) menjadi penyusunnya (hidrogen dan oksigen) dengan menggunakan listrik disebut elektrolisis. Gas yang diperoleh sebagai hasil elektrolisis dapat digunakan sendiri - misalnya, hidrogen berfungsi sebagai salah satu sumber energi terbersih. Meskipun nama proses ini mungkin terdengar sedikit pintar, sebenarnya proses ini lebih mudah daripada yang terlihat jika Anda memiliki peralatan, pengetahuan, dan sedikit pengalaman yang tepat.
Langkah
Bagian 1 dari 2: Siapkan Peralatan
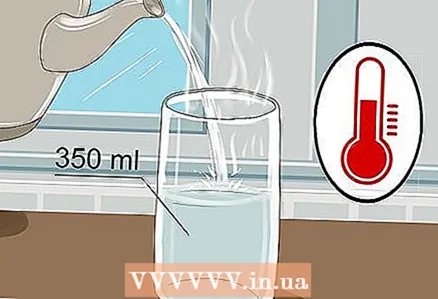 1 Ambil gelas 350 ml dan tuangkan air hangat ke dalamnya. Tidak perlu mengisi gelas sampai penuh, air sedikit saja sudah cukup. Air dingin bisa digunakan, meskipun air hangat menghantarkan listrik lebih baik.
1 Ambil gelas 350 ml dan tuangkan air hangat ke dalamnya. Tidak perlu mengisi gelas sampai penuh, air sedikit saja sudah cukup. Air dingin bisa digunakan, meskipun air hangat menghantarkan listrik lebih baik. - Baik air keran maupun air kemasan bisa digunakan.
- Air hangat memiliki viskositas yang lebih rendah, yang membuat ion lebih mudah bergerak.
 2 Larutkan 1 sendok makan (20 gram) garam meja dalam air. Tuang garam ke dalam gelas dan aduk air hingga larut. Ini akan membuat larutan garam.
2 Larutkan 1 sendok makan (20 gram) garam meja dalam air. Tuang garam ke dalam gelas dan aduk air hingga larut. Ini akan membuat larutan garam. - Natrium klorida (yaitu garam meja) adalah elektrolit yang meningkatkan konduktivitas listrik air. Dengan sendirinya, air tidak menghantarkan listrik dengan baik.
- Setelah Anda meningkatkan konduktivitas listrik air, arus yang dihasilkan oleh baterai akan lebih mudah melewati larutan dan lebih efektif memecah molekul menjadi hidrogen dan oksigen.
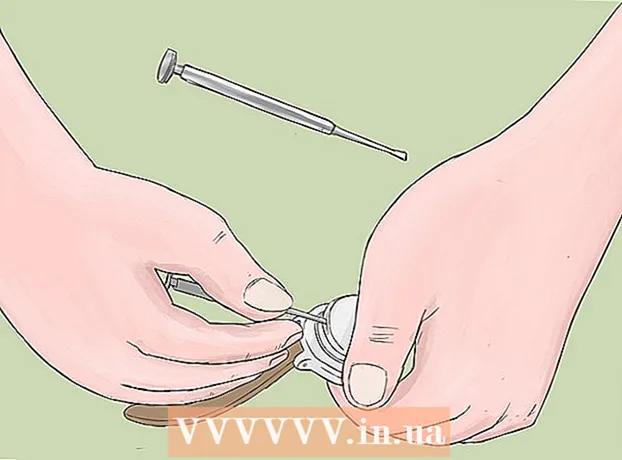
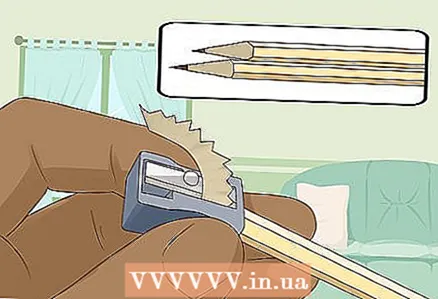 3 Pertajam dua pensil keras-lunak di kedua ujungnya untuk mengekspos timah. Jangan lupa untuk menghapus penghapus dari pensil Anda. Batang grafit harus menonjol di kedua ujungnya.
3 Pertajam dua pensil keras-lunak di kedua ujungnya untuk mengekspos timah. Jangan lupa untuk menghapus penghapus dari pensil Anda. Batang grafit harus menonjol di kedua ujungnya. - Batang grafit akan berfungsi sebagai elektroda berinsulasi tempat Anda menghubungkan baterai.
- Grafit sangat cocok untuk percobaan ini karena tidak larut atau menimbulkan korosi dalam air.
 4 Potong selembar karton yang cukup besar untuk diletakkan di atas kaca. Gunakan selembar karton yang cukup tebal yang tidak akan melorot setelah Anda membuat dua lubang di dalamnya. Potong sepotong persegi dari kotak sepatu atau sejenisnya.
4 Potong selembar karton yang cukup besar untuk diletakkan di atas kaca. Gunakan selembar karton yang cukup tebal yang tidak akan melorot setelah Anda membuat dua lubang di dalamnya. Potong sepotong persegi dari kotak sepatu atau sejenisnya. - Karton digunakan untuk menahan pensil di dalam air agar tidak menyentuh sisi dan dasar gelas.
- Karton bersifat non-konduktif, sehingga Anda dapat dengan aman meletakkannya di atas kaca.
 5 Gunakan pensil untuk membuat dua lubang di karton. Tusuk karton dengan pensil - dalam hal ini, mereka akan dijepit dengan erat dan tidak akan tergelincir. Pastikan grafit tidak menyentuh sisi atau bagian bawah kaca, jika tidak maka akan mengganggu percobaan.
5 Gunakan pensil untuk membuat dua lubang di karton. Tusuk karton dengan pensil - dalam hal ini, mereka akan dijepit dengan erat dan tidak akan tergelincir. Pastikan grafit tidak menyentuh sisi atau bagian bawah kaca, jika tidak maka akan mengganggu percobaan.
Bagian 2 dari 2: Lakukan eksperimen
 1 Hubungkan satu kabel dengan klip buaya ke setiap terminal baterai. Baterai akan berfungsi sebagai sumber arus listrik, dan melalui kabel dengan klem dan batang grafit, arus akan mencapai air.Hubungkan satu kabel dengan penjepit ke positif dan yang lainnya ke terminal negatif baterai.
1 Hubungkan satu kabel dengan klip buaya ke setiap terminal baterai. Baterai akan berfungsi sebagai sumber arus listrik, dan melalui kabel dengan klem dan batang grafit, arus akan mencapai air.Hubungkan satu kabel dengan penjepit ke positif dan yang lainnya ke terminal negatif baterai. - Menggunakan baterai 6 volt. Jika Anda tidak memilikinya, Anda dapat menggunakan baterai 9 volt sebagai gantinya.
- Baterai yang sesuai dapat diperoleh dari toko peralatan listrik atau supermarket.
 2 Hubungkan ujung kabel lainnya ke pensil. Pasang klem kawat logam dengan kuat ke batang grafit. Anda mungkin perlu mengupas lebih banyak kayu dari pensil agar klip tidak terlepas dari batang grafit.
2 Hubungkan ujung kabel lainnya ke pensil. Pasang klem kawat logam dengan kuat ke batang grafit. Anda mungkin perlu mengupas lebih banyak kayu dari pensil agar klip tidak terlepas dari batang grafit. - Dengan demikian, Anda akan menutup sirkuit, dan arus dari baterai akan mengalir melalui air.
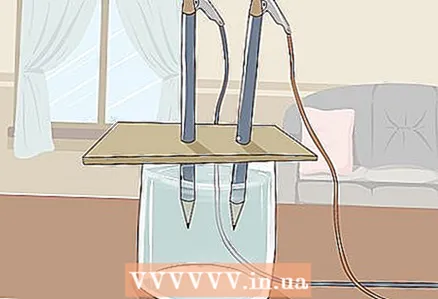 3 Letakkan karton di atas kaca sehingga ujung pensil yang bebas terendam air. Lembaran karton harus cukup besar untuk diletakkan di atas kaca. Berhati-hatilah agar tidak mengganggu penempatan pensil yang benar.
3 Letakkan karton di atas kaca sehingga ujung pensil yang bebas terendam air. Lembaran karton harus cukup besar untuk diletakkan di atas kaca. Berhati-hatilah agar tidak mengganggu penempatan pensil yang benar. - Agar percobaan berhasil, grafit tidak boleh menyentuh dinding dan bagian bawah kaca. Periksa ini lagi dan sesuaikan pensil jika perlu.
 4 Saksikan air terbelah menjadi hidrogen dan oksigen. Gelembung gas akan mulai naik dari batang grafit yang dicelupkan ke dalam air. Ini adalah hidrogen dan oksigen. Hidrogen akan dilepaskan di kutub negatif dan oksigen di kutub positif.
4 Saksikan air terbelah menjadi hidrogen dan oksigen. Gelembung gas akan mulai naik dari batang grafit yang dicelupkan ke dalam air. Ini adalah hidrogen dan oksigen. Hidrogen akan dilepaskan di kutub negatif dan oksigen di kutub positif. - Segera setelah Anda menghubungkan kabel ke baterai dan batang grafit, arus listrik akan mengalir melalui air.
- Lebih banyak gelembung gas akan terbentuk pada pensil yang terhubung ke kutub negatif, karena setiap molekul air terdiri dari dua atom hidrogen dan satu atom oksigen.
Tips
- Jika Anda tidak memiliki pensil dengan batang grafit, Anda dapat menggunakan dua kabel kecil sebagai gantinya. Cukup bungkus salah satu ujung setiap kabel di sekitar kutub baterai yang sesuai dan celupkan ujung lainnya ke dalam air. Hasilnya akan sama dengan pensil.
- Coba gunakan baterai yang berbeda. Jumlah arus yang mengalir tergantung pada tegangan baterai, yang, pada gilirannya, mempengaruhi laju pemecahan molekul air.
Peringatan
- Jika Anda menambahkan elektrolit, seperti garam, ke dalam air, ingatlah bahwa eksperimen akan menghasilkan sejumlah kecil produk sampingan seperti klorin. Aman dalam jumlah kecil seperti itu, tetapi Anda dapat mencium sedikit bau klorin.
- Lakukan percobaan ini di bawah pengawasan orang dewasa. Hal ini terkait dengan listrik dan gas dan karena itu dapat berbahaya, meskipun tidak mungkin.
Apa yang kamu butuhkan
- Dua pensil keras-lunak
- Satu baterai 6 atau 9 volt
- Gelas dengan volume 350 mililiter
- 2 kabel dengan klip buaya
- Rautan untuk pensil
- Garam