Pengarang:
Louise Ward
Tanggal Pembuatan:
11 Februari 2021
Tanggal Pembaruan:
1 Juli 2024

Isi
Ukuran atom sangat kecil sehingga sulit untuk mengukur nomor atom suatu senyawa kimia secara akurat. Untuk dapat mengukur jumlah zat secara akurat, para ilmuwan menggunakan satuan mol untuk merepresentasikan jumlah atom tertentu. Satu mol zat didefinisikan setara dengan jumlah atom karbon yang terkandung dalam 12 gram isotop 12 karbon, yaitu sekitar 6.022 x 10 atom. Nilai ini disebut bilangan Avogadro, atau konstanta Avogadro. Ini juga disebut sebagai jumlah atom dalam 1 mol unsur apa pun, dan 1 mol massa suatu zat disebut massa molar zat tersebut.
Langkah
Metode 1 dari 2: Hitung massa molar suatu unsur
Definisi massa molar. Massa molar suatu zat adalah massa (dalam gram) dari satu mol zat tersebut. Untuk menghitung massa molar suatu unsur, kalikan massa atomnya dengan faktor konversi gram per mol (g / mol).
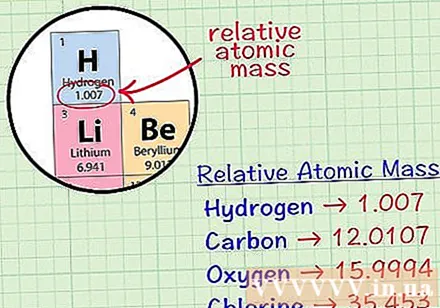
Temukan atom kubik rata-rata suatu unsur. Atom massa rata-rata suatu unsur adalah massa rata-rata, dalam satuan atom, dalam sampel yang mencakup semua isotop unsur tersebut. Informasi ini sering diberikan pada tabel unsur periodik. Dengan mencari sebuah elemen, Anda dapat menemukan atom kubik rata-rata yang ditulis tepat di bawah simbol kimianya. Nilai ini bukan bilangan bulat, tetapi angka dengan desimal.- Misalnya, dengan hidrogen, massa atom rata-rata adalah 1,007; Atom kubik karbon rata-rata adalah 12.0107; Atom massa rata-rata oksigen adalah 15,9994; klorin memiliki massa atom rata-rata 35.453.

Kalikan atom massa rata-rata dengan konstanta massa molar. Satuan molar glide didefinisikan sebagai 0,001 kilogram per mol, atau 1 gram per mol. Produk dari atom massa rata-rata dan konstanta massa molar mengubah satuan massa atom menjadi gram per mol, sehingga massa molar hidrogen adalah 1,007 gram per mol, karbon adalah 12. , 0107 gram per mol, oksigen 15.9995 gram per mol, dan klorin adalah 35.453 gram per mol.- Beberapa unsur ada di alam sebagai molekul yang terdiri dari dua atau lebih atom yang sama. Artinya, jika Anda ingin menghitung massa molar senyawa yang terdiri dari lebih dari satu atom, seperti gas hidrogen, gas oksigen, atau gas klor, Anda perlu menentukan massa atom rata-rata senyawa dan mengalikan nilainya. dengan konstanta massa molar, '' lalu '' kalikan hasil kali yang baru saja Anda temukan dengan 2.
- Dengan H2: 1.007 x 2 = 2.014 gram per mol; untuk o2: 15,9994 x 2 = 31,9988 gram per mol; dan Cl2: 35.453 x 2 = 70.096 gram per mol.
Metode 2 dari 2: Hitung massa molar senyawa tersebut

Tentukan rumus struktur senyawa. Rumus struktur suatu zat memberikan nomor atom setiap unsur yang menyusun senyawa itu. (Informasi ini tersedia di semua buku referensi). Misalnya, rumus kimia asam klorida adalah HCl; glukosa adalah C.6H.12HAI6. Dengan rumus struktur ini, kita dapat menentukan jumlah setiap jenis atom yang menyusun senyawa yang dipertimbangkan.- Dimana HCl memiliki satu atom hidrogen dan satu atom klor.
- Molekul gula glukosa C.6H.12HAI6 memiliki 6 atom karbon, 12 atom hidrogen dan 6 atom oksigen.
Tentukan massa rata-rata atom setiap unsur penyusunnya. Gunakan tabel periodik untuk mencari atom massa rata-rata setiap unsur yang ada dalam senyawa. Atom massa rata-rata biasanya ditulis di bawah simbol kimiawi unsur pada tabel periodik. Mirip dengan menghitung massa molar suatu unsur, kalikan massa atom rata-rata dengan 1 gram / mol.
- Atom massa rata-rata dari unsur-unsur pembentuk asam klorida adalah sebagai berikut: hidrogen 1.007 g / mol dan klorin 35.453 g / mol.
- Atom massa rata-rata dari unsur-unsur penyusun molekul glukosa adalah: karbon, 12.017 g / mol; hidrogen, 1.007 g / mol; dan oksigen, 15,9995 g / mol.
Hitung massa molar setiap elemen komponen. Mengalikan massa atom unsur dengan jumlah atom yang dikontribusikannya dalam suatu senyawa menghasilkan massa rata-rata unsur dalam senyawa tersebut.
- Dalam kasus asam klorida, asam klorida, massa molar unsur hidrogen adalah 1.007 g / mol, dan klorin adalah 35.453 g / mol.
- Dalam kasus glukosa, C.6H.12HAI6, massa molar masing-masing unsur adalah sebagai berikut: karbon, 12.0107 x 6 = 72.0642 g / mol; hidrogen, 1.007 x 12 = 12.084 g / mol; oksigen, 15,9995 x 6 = 95,9964 g / mol.
Massa molar total dari unsur-unsur penyusunnya. Massa molar total unsur-unsur pengomposan adalah massa molar senyawa.Pada langkah sebelumnya kita menghitung massa molar setiap elemen yang ada dalam senyawa, pada langkah ini kita hanya perlu menjumlahkan semua nilai ini.
- Massa molar asam klorida 1.007 + 35.453 = 36.460 g / mol. 36,46 gram adalah massa 1 mol asam klorida.
- Massa molar glukosa adalah 72.0642 + 12.084 + 95.9964 = 180.146 g / mol. Jadi setiap mol glukosa memiliki massa 180,14 gram.
Nasihat
- Meskipun dalam banyak kasus, massa atom rata-rata dicatat ke 1 bagian terdekat 1000 (4 tempat desimal), di laboratorium, massa molar sering kali dikurangi menjadi 2 tempat desimal, terkadang bahkan lebih sedikit, untuk molekul besar. Oleh karena itu, dalam kasus laboratorium, massa molar asam klorida dapat dituliskan sebagai 36,46 g per mol, untuk glukosa 180,14 g per mol.
Apa yang kau butuhkan
- Buku referensi kimia atau tabel periodik unsur
- Komputer



